
磁珠法微量病毒DNA提取试剂盒
分类:微量病毒DNA提取目录:DE07
产品特性:
| 高通量:快速高效完成微量病毒DNA提取过 |
| 方便:无需高温洗脱,减少挥发和交叉污染 |
| 生物安全:第一步操作即裂解细胞、变性蛋白 |
| 自动化适用 |
本试剂盒用于提取血清、血浆、咽拭子等液体样本中的微量病毒核酸(DNA)。试剂盒由高效吸附核酸的超顺磁性纳米微球和安全环保的提取试剂体系组成:经过独特的表面修饰的磁珠,结合核酸能力更强;操作步骤简单,操作时间短,整个操作过程都在室温下进行,因此也非常适合于病毒DNA的磁珠自动化提取过程。纯化的病毒DNA可适用于各种下游操作,包括酶切、PCR、文库构建、Southern杂交、基因测序等实验。
操作流程(示意图):
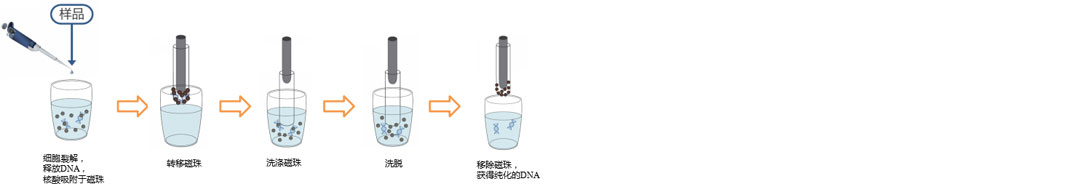
略。
| 目录号 | 规格 | 适用机型 |
|---|---|---|
| DE07001 | 20份 | 瓶装,适用于手工提取及Tecan、Hamilton等自动移液工作站 |
| DE07002 | 100份 | 瓶装,适用于手工提取及Tecan、Hamilton等自动移液工作站 |
| DE07003 | 500份 | 瓶装,适用于手工提取及Tecan、Hamilton等自动移液工作站 |
| DE0796A | 96份 | Thermo Scientific KingFisher自动纯化系统 |
| DE0796B | 96份 | 医脉赛、圆点、奥盛、天隆、天根等品牌多种纯化机型 |
| DE0760C | 60份 | Thermo Scientific KingFisher mL磁珠提取仪 |
| DE0796D | 96份 | Thermo Scientific KingFisher Flex纯化系统 |
我们提供了多种订购渠道和订购方式:
1.直接电话联系我们:400-880-7356;021-60556823
2.直接邮箱联系我们:order@emerther.cn
3.直接点击“在线预订”,即可跳转第三方页面,按照第三方页面流程点击“立即订购”即可(具体操作可参考以下视图)。
【手动提取步骤】
1. 溶解蛋白酶K:按标签所示,吸取PK溶解液至蛋白酶K干粉中配制成蛋白酶K溶液20mg/ml,颠倒混匀数次让蛋白酶K充分溶解;
2. 将液体样本混合均匀,取200µl样本放入2ml离心管中,加入10µl溶液ER、10μl蛋白酶K、700µl裂解吸附液、25µl提取磁珠,置于旋转混和仪,充分混匀25min;
3. 用磁分离架吸附磁珠,弃上清液;
4. 加入700µl洗涤液I洗涤磁珠,将含磁珠的洗涤液转移至另一干净离心管中,颠倒混匀洗涤1-2min,吸附磁珠,弃上清液;
5. 再加入700µl洗涤液I洗涤磁珠1-2min,吸附磁珠,弃上清液;
6. 加入700µl洗涤液II洗涤磁珠1-2min,吸附磁珠,弃上清液;
7. 再次加入700µl洗涤液II洗涤磁珠1-2min,将含磁珠的洗涤液移至另一干净离心管中;
8. 吸附磁珠,弃上清液后静置5min,去除乙醇残留;
9. 加入50µl洗脱液,混和洗脱5min;
10. 磁场吸附磁珠,回收含DNA的洗脱液至另一离心管,进行DNA检测及后续实验。
【自动化提取步骤(以32通道为例)】
1. DE0796B预装板设置(96孔深孔板,样品量200µl,16通量)

2. 从试剂盒中取出预封装96深孔板,轻甩96深孔板使试剂及磁珠均集中到96深孔板底部。使用前小心撕去铝箔封口膜,避免96深孔板振动,防止液体溅出(注意:室温低
于15°C时,请在使用前将96孔板置于37°C预热20min,以避免沉淀析出);
3. 在第1列、第7列中加入200µl样本、10μl蛋白酶K溶液以及10μl溶液ER;
4. 放置2个8道磁套;选择附表所列的自动化提取程序,开始提取;客户可按所使用的核酸自动提取仪适当调整程序,如果有问题,请联系技术支持;
5.转移第6列、第12列中含核酸的洗脱液,用于后续检测或-20°C储存。
| 步骤 | 孔位 | 名称 | 混合时间(sec.) | 磁吸时间(sec.) | 等待时间(sec.) | 容积(μl) | 混合速度 | 温度(℃) |
|---|---|---|---|---|---|---|---|---|
| 1 | 1 | 裂解 | 600 | 0 | 0 | 900 | 快 | 37 |
| 2 | 1 | 结合 | 900 | 30 | 0 | 900 | 快 | 37 |
| 3 | 1 | 吸磁 | 30 | 30 | 0 | 700 | 中 | 室温 |
| 4 | 2 | 洗涤1 | 120 | 30 | 0 | 700 | 中 | 室温 |
| 5 | 3 | 洗涤2 | 120 | 30 | 0 | 700 | 中 | 室温 |
| 6 | 4 | 洗涤3 | 120 | 30 | 0 | 700 | 中 | 室温 |
| 7 | 5 | 洗涤4 | 120 | 30 | 120 | 700 | 中 | 室温 |
| 8 | 6 | 洗脱 | 300 | 60 | 0 | 50 | 快 | 常温 |
| 9 | 4 | 移去磁珠 | 60 | 0 | 0 | 700 | 中 | 室温 |
1、 微量病毒DNA提取试剂盒与病毒DNA提取试剂盒的区别在哪里?
答:医脉赛微量病毒DNA提取试剂盒可以更好地提取极微量的病毒DNA (<10 IU/ml[J1] ),适合于检测极微量的病毒。
2、手动提取时,洗脱前是否可以将样本放进烘箱挥发样本中乙醇?
答:不可以,洗涤液II洗涤后,尽量将残留液体去除后,让样品在室温下静置3-5min或更长时间以挥发乙醇,然后加入洗脱液。如乙醇残留太多会对后续检测有一定影响;但样品如果过于干燥,可能导致DNA不容易从磁珠上洗脱下来,减少提取量。
3、 能否更换为双蒸水进行洗脱?
答:洗脱液可以用TE缓冲液(pH7.5-8.5)或双蒸水。
4、液体样本使用量为多少?
答:液体样本使用量可为10-400µl,最佳为200-300µl。